ආවර්තිතා චක්රය
(Periodic Table). මූලද්රව්යවල (මූලධාතුවල) පරමාණුක ක්රමාංක වැඩි වී යන පිළිවෙළට ඒ මූලද්රව්ය පිළියෙල කළ විට ඒවායේ ඉතා පැහැදිලි ආවර්තිතාවක් දක්නට ලැබේ. මූලද්රව්යයන්ගේ ලක්ෂණවල සමානකම් හා අසමානකම් කාර්යෝපයෝගී වන ලෙසත් පහසුවෙන් දැක්වෙන අයුරිනුත් විදහා පෑමට සකස් කර ගත් මූලද්රව්ය චක්රයට ආවර්තිතා චක්රය යයි කියනු ලැබේ.
ඇතැම් මූලද්රව්ය වෙනත් මූලද්රව්යයන්ට කිට්ටු සබඳකම් පෙන්වන බව හැඟවීමට සෑහෙන තරම් කරුණු 19 වැනි ශතවර්ෂයේ මුල් භාගයේ දී ම රසායන විද්යාඥයන්ට ලැබී තිබිණ. හැලජන් නමින් හැඳින්වෙන ෆ්ලුවොරීන්, ක්ලෝරීන්, බ්රෝමීන් හා අයඩීන් යන මූලද්රව්ය මීට හොඳ නිදසුන්ය. රසායනික සබඳකම් දක්වන බොහෝ මූලද්රව්ය තුන තුන බැගින් හෙවත් ත්රික (triads) වශයෙන් දක්නා බැව් ඩෝබරයිනර් (Döbareiner) විසින් පෙන්වන ලදි. නිදසුන් වශයෙන්:
පරමාණුක භාරය
ලිතියම්-6.94
සෝඩියම්-22.99
පොටෑසියම්-39.10
ක්ලෝරීන්-35.45
බ්රෝමීන්-79.91
අයඩීන්-126.92
මේ ත්රිකයක මැද තිබෙන මූලද්රව්යයේ පරමාණුක භාරය අනික් මූලද්රව්ය දෙකේ පරමාණුක භාරයන්හි මාධ්යයයි. ඔක්සිජන්වල පරමාණුක භාරය වන 16 අන්තරය කොට ගත්, අනුරූප ලක්ෂණවලින් යුත් සර්පිල චක්රයක් ලැබෙන සේ 1862 දී ඩ ෂාංකූර්ට්වා (de Chancourtois) විසින් මූලද්රව්යයන්ගේ පරමාණුක භාර චක්රයක් අඳින ලදි. එකිනෙකට කිට්ටු සබඳකම් ඇති මූලද්රව්ය මේ චක්රයේ අනුරූප ස්ථානවල දක්නට ලැබිණි.
පරමාණුක භාර වැඩි වී යන පිළිවෙළට මූලද්රව්ය පිළියෙල කළහොත් එක් එක් මූලද්රව්යයක් එතැන් සිට අටවැනි ස්ථානයෙහි පිහිටි මූලද්රව්යය හා ලක්ෂණ අතින් සමාන බැව් 1863 දී ඉංග්රීසි විද්යාඥයකු වූ ජේ.ඒ. නිව්ලන්ඩ්ස් (Newlands) පෙන්විය. නිව්ලන්ඩ්ස්ගේ මූලද්රව්ය න්යාසය මෙසේය:
මූල ද්රව්යය.......................Li...Be...B...C...N...O...F....Na....Mg....Al....Si....P.....S.....CI....K.....Ca
ආසන්න පරමාණුක භාරය..7....9...11..12..14..16..19....23....24....27....28....31....32....35....39....40
මෙයට අෂ්ටක නියමය (Law of Octaves) යයි නිව්ලන්ඩ්ස් නම් කළේය. ඔහුගේ න්යාසයත් සංගීත ස්වරග්රාමයත් (musical scale) අතර සාම්යයක් ඔහු දැක්වීය. සංගීත ස්වරග්රාමයෙහි ද සෑම ස්වරයක් ම ඉන් අටවැන්නට සමානය. කැල්සියම්වලින් ඔබ්බෙහි වූ මූලද්රව්ය සම්බන්ධයෙන් නිව්ලන්ඩ්ස්ගේ අෂ්ටක නියමය ඒ සා නිවැරදි ලෙස ක්රියා නොකරන බව පෙනේ. එකල සිටි රසායන විද්යාඥයන්ගෙන් බොහෝ දෙනෙක් නිව්ලන්ඩ්ස්ගේ නියමය වැඩි උනන්දුවකින් නොපිළිගත්හ.
1869 දී ඩ්මීට්රි ඉවානවිච් මෙන්ඩලේයෆ් (Dmitri Ivanovich Mendeleeff) නමැති රුසියානු රසායන විද්යාඥයා නිව්ලන්ඩ්ස්ගේ නියමය ගැන කිසිත් නොදැන ම අලුත් ආවර්තිතා නියමයක් ස්වාධීනව ඉදිරිපත් කෙළේය. ඔහුගේ නියමය අනුව මූලද්රව්යයන්ගේ ලක්ෂණ ඒවායේ පරමාණුක භාරවල ආවර්ත ශ්රිතයෝය (functions). ඒ අනුව පරමාණුක භාර වැඩි වී යන පිළිවෙළට මූලද්රව්ය පිළියෙල කළහොත් සමාන ලක්ෂණ ඇති මූලද්රව්ය පිහිටා ඇත්තේ සමාන අන්තර ඇතිව බව පෙනේ. මඳ වශයෙන් වෙනස් කොට ගත් මෙම මූලධර්මය ආවර්තිතා චක්රයෙහි පදනම වේ. එක් මූලද්රව්යයක ලක්ෂණවලට සමාන ලක්ෂණ ඇති මූලද්රව්යයක් නැවත හමු වන තුරු මූලද්රව්ය හරස් අතට ලියමින් මෙන්ඩලේයෆ් චක්රයක් සකස් කළේය. මේ ලැයිස්තුවේ හරස් පේළිවලට ආවර්ත (periods) යන නාමය ද සිරස් පේළිවලට කාණ්ඩ (groups) යන නාමය ද දෙන ලදි. මෙන්ඩලේයෆ් විසින් සකස් කරන ලද මේ චක්රයෙහි සමාන ලක්ෂණ ඇති මූලද්රව්ය එක කාණ්ඩයක ඇතුළත් වේ. නිදසුන් වශයෙන් කිවහොත් ෆ්ලුවොරීන්, ක්ලෝරීන්, බ්රෝමීන් හා අයඩීන් එක් කාණ්ඩයකත් නයිට්රජන්, පොස්පරස්, ආසනික් හා ඇන්ටිමනි එක් කාණ්ඩයකත් මැග්නීසියම්, කැල්සියම්,ස්ට්රොන්ෂියම් හා බේරියම් එක් කාණ්ඩයකත් ඇතුළත් වේ.
මෙන්ඩලේයෆ්ගේ චක්රයේ පදනම නිව්ලන්ඩ්ස්ගේ න්යාසයේ පදනමට සමාන වුවත් මෙන්ඩලේයෆ් තම චක්රය පිළියෙල කරද්දී නිව්ලන්ඩ්ස් වඩා සවිස්තරව කරුණු විභාග කළේය. එවක නොදත් මූලද්රව්යයක් වී නම් ඒ මූලද්රව්යයට චක්රයේ හිස් තැනක් නොතැබුවහොත් චක්රය ව්යාකූල විය හැකි බැව් මෙන්ඩලේයෆ්ට අවබෝධ වීම තවත් සැලකිය යුතු කරුණකි. අලුත් මූලද්රව්යයක් චක්රයෙහි ඇතුළත් කිරීම සඳහා අවශ්ය වේ යයි ඔහුට පෙනීගිය ස්ථාන ඔහු හිස්ව තැබුවේය. එකල නොදත් මූලද්රව්ය තුනක පැවැත්ම හා ලක්ෂණ මේ ක්රමයෙන් ඔහු අනාවැකියක් සේ කියා සිටියේ ය. ඉන් වර්ෂ ස්වල්පයක් ඇතුළත ස්කැන්ඩියම්, ගැලියම් හා ජර්මේනියම් නමින් දන්නා මූලද්රව්ය තුන ම අලුතෙන් සොයා ගන්නා ලදි. ඒවායේ ලක්ෂණ මෙන්ඩලේයෆ් කියා සිටි ලක්ෂණ හා බොහෝ දුරට සමානය. කලින් පිළිගැනී තුබූ පරමාණුක භාර කීපයක් ද ආවර්තිතා චක්රයෙහි නිසි ස්ථානවලට ඇතුළත් නොකළහැකි වූ බැවින් ඇතැම් පරමාණුක භාර වැරදි බව පෙන්වීමට ද ඔහුට පිළිවන් විය. ඔහු බේරියම්වල පරමාණුක භාරය 13.8න් 9.2ට ද ඉන්ඩියම්වල පරමාණුක භාරය 76න් 114ක් ද වෙනස් කළේය.
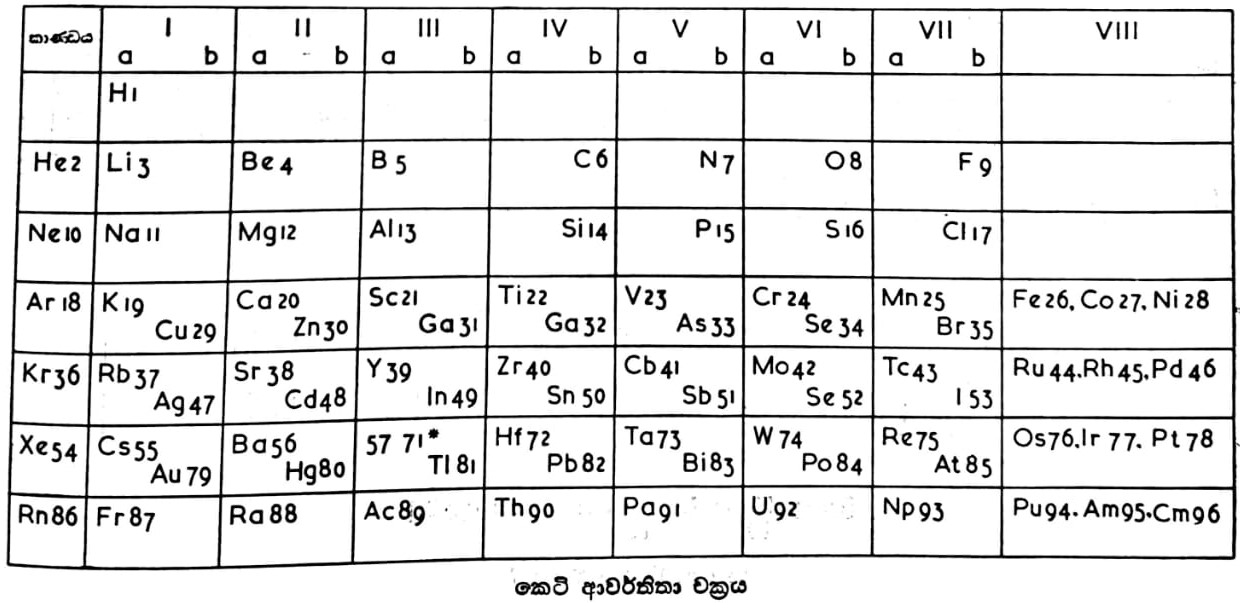
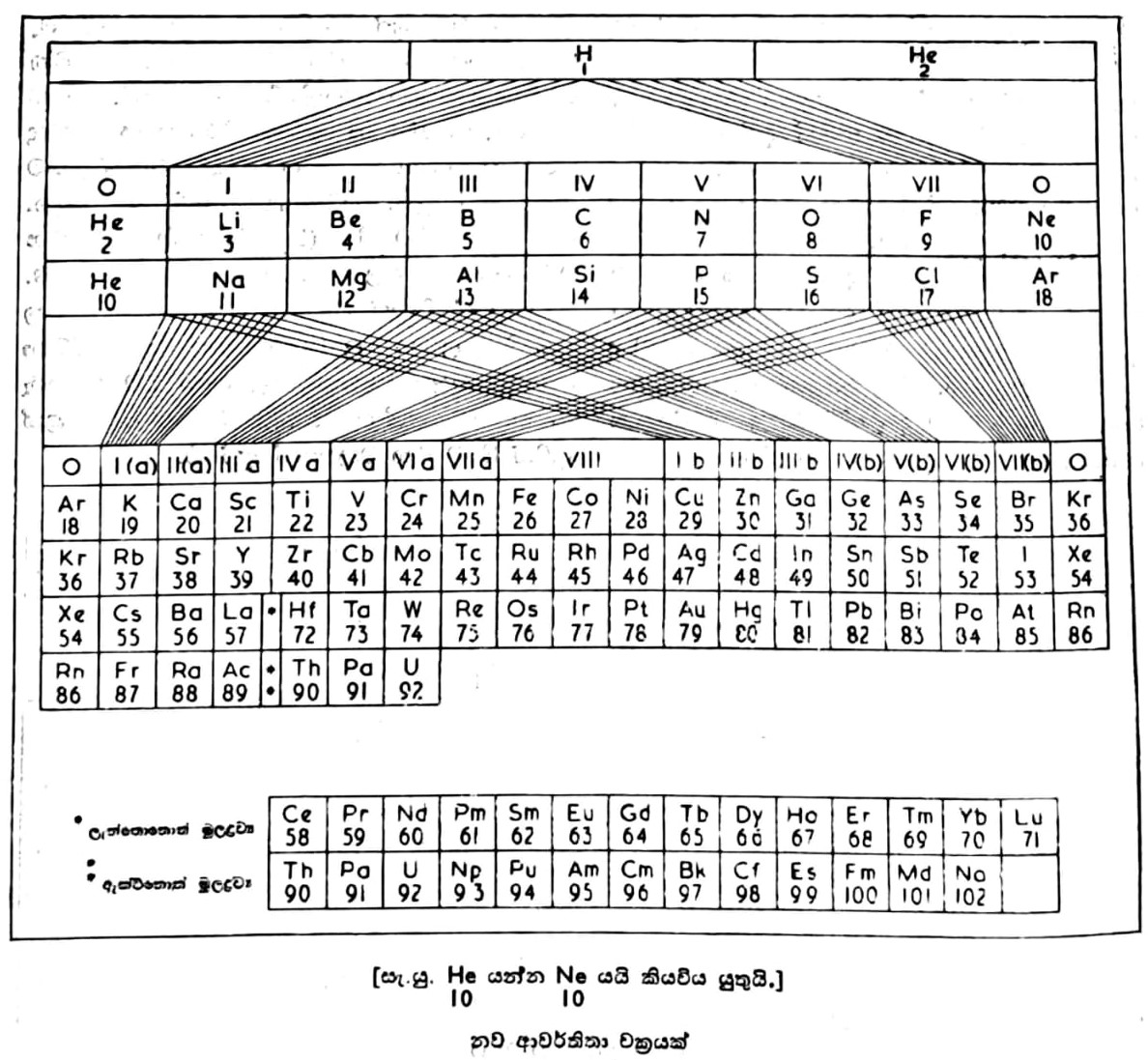
මෙන්ඩලේයෆ් සිය ආවර්තිතා චක්රය සකස් කළේ පරමාණුක භාර වැඩි වී යන පිළිවෙළට මූලද්රව්ය පිළියෙල කිරීමෙනි. පසුව ඔහුගේ චක්රයේ ඇතැම් අඩුපාඩු පෙනී ගිය හෙයින් ද රසායන විද්යාව තවදුරටත් දියුණුවු හෙයින් ද අලුත් මතයක් ඉදිරිපත් විණි. මේ මතය අනුව මූලද්රව්යයක ලක්ෂණයන්ගේ නියම ශ්රිතය වනුයේ පරමාණුක භාරය නොව ඒ මූලද්රව්යයේ පරමාණුක ක්රමාංකය හෙවත් පරමාණුවේ න්යෂ්ටියේ මුලු ධන ආරෝපණයයි. දැනට ශතවර්ෂයකට පමණ පෙර ම ආවර්තිතා පිළිවෙළ පිළිබඳ මුලධර්මය ස්ථිර වශයෙන් ප්රතිෂ්ඨාපිතව තුබුණ ද එය ඉදිරිපත් කළයුතු පිළිවෙළ කුමක් ද යන්න එකල සිට වාද විවාදයට භාජනව පැවැතුණේය. දැන් ආවර්තිතා චක්ර දෙවර්ගයක් භාවිත කරනු ලැබේ. සාමාන්යයෙන් වැඩිපුර භාවිත කරනු ලබන චක්රයෙහි පදනම මෙන්ඩලේයෆ්ගේ චක්රයයි. මෙහි මූලද්රව්ය, කාණ්ඩ හා උප-කාණ්ඩ වශයෙන් බෙදා තිබේ. අනික් වර්ගයේ චක්රය විස්තාරිත පිළිවෙළකට සකස් කර ඇත. මෙහි උප-කාණ්ඩ නොමැත. මෙහි අන්තර්වර්තී (transitional) මූලද්රව්ය වඩා පැහැදිලි ලෙස එකට සංග්රහ කර තිබේ. මෙන්ඩලේයෆ්ගේ චක්රයට වඩා මෙවැනි චක්රයකින් මූලද්රව්ය ලක්ෂණයන්ගේ සම්බන්ධතා පැහැදිලි ලෙස සඳහන් කළ හැකි බව සමහරු කියති. බොහෝ දෙනා පිළිගත් අලුත් පිළිවෙළක් අනික් පිටේ එන චක්රයෙන් දැක්වේ.
මේ චක්රයේ මූලද්රව්ය පිළියෙල කර ඇත්තේ පරමාණුක ක්රමාංක වැඩි වී යන පිළිවෙළටය. එක් එක් මූලද්රව්යය චක්රයෙහි ඊට ම වෙන් වූ තනි කොටුවක තබා ඇත. මූලද්රව්යයෙහි සංකේතය, පරමාණුක ක්රමාංකය හා පරමාණුක භාරය මේ කොටුවෙහි සාමාන්යයෙන් සඳහන් කරනු ලැබේ. සංකේතවලට පහළින් පරමාණුක ක්රමාංක පමණක් මේ චක්රයෙහි දැක්වේ. චක්රය මූලද්රව්ය කාණ්ඩ 9කට ද ආවර්ත 7කට ද බෙදනු ලැබේ. කාණ්ඩ 9න් 7ක් තවදුරටත් a සහ b යන ජාතිවලට බෙදා ඇත. a ජාතියට අයත් මූලද්රව්ය ප්රධාන කාණ්ඩ වශයෙන් ද b ජාතියට අයත් මූලද්රව්ය උප-කාණ්ඩ වශයෙන් ද වර්ග කරනු ලැබේ. 3 වැනි කාණ්ඩයේ ලා ගැණෙන මූලද්රව්ය වශයෙන් ඉතා හොඳින් වර්ග කළ හැකි ලැන්තනයිඩ් හෙවත් විරල පාංශු (rare earths) ශ්රෙණිය හා ඇක්ටිනයිඩ් ශ්රෙණිය චක්රයෙහි ප්රධාන කොටසෙන් පිට විශේෂ ස්ථානවල යොදා ඇත. මීට හේතුව ආවර්ත 6 සහ 7 තුළ නියම ස්ථානවල ඒවා පහසුවෙන් ඇතුළත් කළ නොහැකි වීමය. පරමාණුක භාර සංසන්දනය කිරීම සඳහා ඒකකය ලෙස ඩෝල්ටන් (බ.) ගත් හයිඩ්රජන් මූලද්රව්යය ආවර්තිතා චක්රයේ පළමුවැනි ස්ථානයෙහි යොදා ඇත. දැන් පවතින තත්වය අනුව 102 වැනි පරමාණුක ක්රමාංකය දක්වා චක්රයේ ස්ථාන සියල්ල ම පිරී ඇත. 1 සිට 102 දක්වා පරමාණුක ක්රමාංක ඇති මූලද්රව්ය සියල්ල ම දැනට සොයාගෙන තිබේ. 102ට අධික වූ ක්රමාංක ඇති අලුත් මූලද්රව්ය න්යෂ්ටික ප්රතික්රියා මගින් සෑදේ යයි අපේක්ෂා කරනු ලැබේ. ආවර්තිතා චක්රයෙහි මූලද්රව්ය අතර දක්නට ලැබෙන සම්බන්ධන ලක්ෂණ කීපයක් පහත සදහන් වේ:
1.සංයුජතාව
චක්රයේ එකම කාණ්ඩයක ඇතුළත් වන මූලද්රව්යයන්ගේ සංයුජතාව එක සමානය. තවද ඒවායේ සංයුජතාවේ අගය එම කාණ්ඩයේ අංකයට සමානය. මේ රීතිය ප්රධාන කාණ්ඩ 1 සිට 5 දක්වා ඇති කාණ්ඩ කෙරෙහි ඉතා තදින් බලපායි. උප-කාණ්ඩගත මූලද්රව්ය කෙරෙහි එය බලපාන්නේ මීට අඩු වශයෙනි. 6 වැනි, 7 වැනි හා 8 වැනි කාණ්ඩවල මූලද්රව්ය කෙරෙහි එය බලපාන්නේ මීටත් අඩු වශයෙනි. දිග ශ්රේණිවල මධ්යයට සමීපයෙන් තිබෙන මූලද්රව්යවල සංයුජතා අගයන් දෙකක් හෝ ඊට වැඩි ගණනක් ඇත. එහෙත් චක්රයේ පෙන්වන්නේ එක් සංයුජතා අගයක් පමණකි.
2.ලෝහ හා අලෝහ
මූලද්රව්යයන් ලෝහ හා අලෝහ වශයෙන් ස්වාභාවික ලෙස බෙදී ඇති බව ආවර්තිතා චක්රයෙහි දක්නට ලැබේ. ඕනෑ ම කාණ්ඩයක ඇතුළත් මූලද්රව්යයන්ගේ පරමාණුක භාරය වැඩිවත් ම ඒවායේ ලෝහමය ලක්ෂණ වඩ වඩාත් පැහැදිලි සේ පෙනේ. පළමුවැනි කාණ්ඩය වැනි සමහර කාණ්ඩවල ඇතුළත්වන්නේ ලෝහ පමණකි. චක්රයෙහි වමේ සිට දකුණ දක්වා බලන විට මූලද්රව්යවල ලෝහමය ලක්ෂණ අඩු වී අලෝහමය ලක්ෂණ වැඩි වේ. 6 a කාණ්ඩයේ සිට 7 a කාණ්ඩය දක්වා තිබෙන සැහැල්ලු මූලද්රව්ය ලෝහය. නිදර්ශක ස්වරූපයෙන් ගත හැකි අලෝහ මූලද්රව්ය 7 b කාණ්ඩයෙහි දක්නට ලැබේ. මේවා හැලජන් නමින් හැඳින්වේ. නියම ලෝහමය මූලද්රව්ය අතර හා අලෝහ අතර ප්රදේශයෙහි වඩා පැහැදිලි නොවූ ලක්ෂණයන්ගෙන් යුත් මූලද්රව්ය කීපයක් (ජර්මේනියම්, ආසනික්, ඇන්ටිමනි, ටෙලූරියම් හා පොලෝනියම්) ඇත. මේ මූලද්රව්යයන්ගේ ලක්ෂණ, ලෝහ හා අලෝහ අතර අන්තර්වර්තීය.
3.විද්යුත්-ධනභාවය
මේ ලක්ෂණය සාමාන්යයෙන් ලෝහ සමඟ සම්බන්ධ වේ. 1 වැනි කාණ්ඩයේ බර මූලද්රව්යයෝ විද්යුත්-ධනභාවය ඉතා ම වැඩි ප්රමාණයෙන් දක්වත්. එය අඩුවනුයේ ඉහළින් තිබෙන මූලද්රව්යවලත් ඊට දකුණෙන් තිබෙන මූලද්රව්යවලත්ය.
ඔක්සිකරණ විභවය ((potential), විද්යුත්සන්නායකතාව, ද්රවාංකය, තාපාංකය, අයනීකරණ විභවය, ඉලෙක්ට්රෝන බන්ධුතාව හා චුම්බකත්ව අනුග්රහය යනාදිය ප්රතිසම ප්රවණතා හා ආවර්තිතා දක්වන ලක්ෂණවලින් කීපයකි.
19 වැනි ශත වර්ෂයේ මැද භාගයේ දී මෙන්ඩලේයෆ් විසින් සම්පාදිත ආවර්තිතා චක්රය පසුව ලබාගත් විද්යාඥානය අනුව තරමක් වෙනස් කරන්නට සිදු විය. මූලද්රව්යයන්ගේ රසායන ලක්ෂණ හා ඒවායේ පරමාණුක භාර අතර සබඳකමක් මෙන්ඩලේයෆ් ඔහුගේ චක්රයෙහි දුටුවේය. පරමාණුක භාරය සම්පූර්ණයෙන් ම වාගේ නිර්ණය කරන පරමාණුක න්යෂ්ටිය රසායන ප්රතික්රියාවන්හි වැදගත් තැනක් නොගන්නා බව දැන් දැනගෙන ඇති කරුණකි. මූලද්රව්යයක රසායනික ක්රියාව නිර්ණය කරනු ලබන්නේ එහි පරමාණුවල තිබෙන ඉලෙක්ට්රෝන, විශේෂයෙන් ම න්යෂ්ටියට ඈතින් ම තිබෙන ඉලෙක්ට්රෝන, මගිනි. 20 වැනි ශතවර්ෂයේ මුල් භාගයේ දී කරන ලද පර්යේෂණ හේතු කොටගෙන පරමාණුක ව්යූහය පිළිබඳ අපේ දැනීම බොහෝ දුරට දියුණු විය. පරමාණුක ක්රමාංකය විධිමත් ලෙස වැඩි වී යන පරමාණු අනුක්රමයක වූ එක් එක් පරමාණුවක පිටතින් ම තිබෙන ඉලෙක්ට්රෝන කබොලෙහි ඉලෙක්ට්රෝන සංඛ්යාවේත් ඒවායේ වර්ගයේත් ආවර්තිතාවක් ඇති විය යුතුය යන්න දැන් පවත්නා මතයයි. මූලද්රව්යයන්ගේ ලක්ෂණවල දක්නට ලැබෙන ආවර්ත වෙනස්වීම්වල සැබෑ පදනම මෙය වේ.
ආවර්තිතා පිළිවෙළෙහි නියම වැදගත්කම වනුයේ මූලද්රව්යයන්ගේ පෘථුල වර්ගීකරණයක් ඒ මගින් සිදු වී තිබීමයි. චක්රයෙන් ප්රකාශ කෙරෙන ආවර්තිතා නියමය පදාර්ථයන්ගේ පොදු පදනම පිළිබඳ පැරණි මතය කෙරෙහි යළිත් විද්යාඥයන්ගේ සිත් යොමු කළේය. මේ මතය පරීක්ෂණාත්මක ලෙස ඔප්පු කිරීමට සාක්ෂි ලබාගත හැකි වූයේ ඉතා මෑතක දීය. භෞතික ලෝකයේ ස්වභාවය පිළිබඳ රහස් අනාවරණය කිරීම සම්බන්ධයෙන් මහඟු සේවයක් ආවර්තිතා සංකල්පයෙන් සිදු වූ බව අවිවාදයෙන් පිළිගත යුත්තකි. අනාගතයේ දී සොයා ගනු ලබන කවර මූල ද්රව්යයකට වුව ද ආවර්තිතා චක්රයෙහි සුදුසු ස්ථානයක් ලැබෙනු නිසැකය.
(සංස්කරණය: 1965)