ඉලෙක්ට්රෝන වින්යාසය
(Electron Configuration). පරමාණුව පිළිබඳ නූතන සංකල්පය අනුව එය ප්රෝටෝන හා නියුට්රෝනවලින් සෑදුණු ධන ලෙස ආරෝපිත වූ සූක්ෂ්ම න්යෂ්ටියකින් ද න්යෂ්ටිය වටා නියමිත කක්ෂවල හෙවත් කවචවල (shells) භ්රමණය වන ඍණ ලෙස ආරෝපිත වූ ඉලෙක්ට්රෝනවලින් ද සමන්විතය. පරමාණුවක ඉලෙක්ට්රෝන එක් එක් කක්ෂයක පිළියෙල වී තිබෙන ආකාරය ඒ පරමාණුවේ ඉලෙක්ට්රෝන වින්යාසය යනුවෙන් හැඳින්වේ. නොයෙක් මූලද්රව්යයන්ගේ පරමාණුවල ඉලෙක්ට්රෝන පිළියෙල වී තිබෙන ආකාරය කෙසේ ද යන වැදගත් ප්රශ්නය විසඳීමට බෝර් (Bohr) වාදය උපයෝගී කර ගැනීමෙන් පුළුවන් විය. පරමාණුවේ ඇති ඉලෙක්ට්රෝනවල හැසිරීම පිළිබඳ ක්වොන්ටම් යාන්ත්රික විද්යාත්මක නිගමනයන්ගේ නිරවද්යතාව තහවුරු කිරීමට බෝර්ගේ පර්යේෂණ ඉවහල් විය. පසුව සොමර්ෆෙල්ට් (Sommerfeld), ලුවිස් (Lewis), ලැංමුවර් (Langmuir), ෂ්රේඩිංගර් (Schrödinger) හා වෙනත් අය විසින් බෝර්වාදය මඳක් වෙනස් කොට එය තවදුරටත් විස්තාර කරන ලදි. මූලද්රව්යවල වර්ණාවලීන්ගෙන් (spectra) ලබාගත් කරුණු උපයෝගී කොටගත් නවතර ක්වොන්ටම්වාදය සියලු ම මූලද්රව්යයන්ගේ පරමාණුවල ඉලෙක්ට්රෝන පිළියෙල වී තිබෙන ආකාරය බොහෝ දුරට නිසැකව ම වාගේ අවබෝධ කරගැනීමට අපට උපකාරී වී තිබේ.
ඒකකේන්ද්රීය වළලු (rings) කිහිපයක් සාදමින් එක ම වෘත්තාකාර කක්ෂ දිගේ සමූහ වශයෙන් ඉලෙක්ට්රෝන චලනය වෙතැයි මුල දී සිතා ගන්නා ලදි. ඉලෙක්ට්රෝනයන් පරමාණු න්යෂ්ටි වටා සීමාසහිත වූ ද නියමිත හැඩයක් ගත්තා වූ ද කක්ෂයන්හි භ්රමණය වෙමින් පවතිතැයි යන සංකල්පය පින්තූර මගින් මෙන් දැක්වෙන දළ අදහසකට වඩා වැඩිමනත් නූවූවක් සේ ගිණිය හැකිය. නූතන සංකල්ප අනුව ඉලෙක්ට්රෝන සලකනු ලබන්නේ න්යෂ්ටිය හා සම්බන්ධයෙන් ඒවා ශක්ති මට්ටම් (energy levels) කිහිපයක පවතිතැයි යනුවෙනි. එක් එක් ඉලෙක්ට්රෝනයකට ස්වකීයම වු කක්ෂයක් ඇත. මෙය වෘත්තයක් හෝ ඉලිප්සයක් හෝ විය හැකිය. මේ කක්ෂ වෙනස් වෙනස් අයුරින් අවකාශයේ පිළියෙල වී ඇත. එකිනෙක අතර විවිධ කෝණ සාදමින් මේවා න්යෂ්ටිය වටා සිටී. තරංග යාන්ත්ර විද්යාවෙහි ලා "කාක්ෂිකය" (orbital) යන්නෙන් අදහස් කෙරෙන්නේ සාමාන්යයෙන් බොහෝ කොට ම ඉලෙක්ට්රෝනය හැසිරෙන, න්යෂ්ටිය වටා පිහිටි ක්ෂේත්රයයි. න්යෂ්ටිය වටා පිහිටි එක් එක් ස්තරය නියමිත ඉලෙක්ට්රෝන සංඛ්යාවකින් පිරී හෝ සංතෘප්ත වී ඇත. එක ම ස්තරයේ තිබෙන ඉලෙක්ට්රෝන එකිනෙකට සමාන තරම් වාගේ ශක්ති ප්රමාණයක් ලක්ෂණ කොට ඇත. ආසන්න වශයෙන් ඒවා එක ම ශක්ති මට්ටමක තිබේ. තරංග යාන්ත්ර විද්යාව පදනම් කොටගත් නූතන සංකල්පයන්ගේ සැලකිල්ල ප්රධාන වශයෙන් යොමු වී ඇත්තේ ඉලෙක්ට්රෝන ආරෝපණවල සංසන්දනාත්මක ඝනත්වයන් කෙරෙහිය. ඉලෙක්ට්රෝන පිළිබඳ විස්තරයක් ඉතා හොඳින් කළ හැක්කේ ක්වොන්ටම් අංක සතරක් අනුවය. ක්වොන්ටම් අංකයක් වූකලි පරමාණුවක හෝ අණුවක තිබෙන එක් එක් ඉලෙක්ට්රෝනයක ක්වොන්ටම් අවස්ථාව (state) නිරූපණය කිරීම සඳහා යොදන පූර්ණ සංඛ්යාත්මක හෝ අර්ධපූර්ණ සංඛ්යාත්මක හෝ සංඛ්යාවන් සමූහයකින් එකකි. මේ ක්වොන්ටම් අංක සතර උපයෝගී කොට ගැනීමෙන් යම්කිසි පරමාණුවක් සාදන ඉලෙක්ට්රෝනවල ලක්ෂණ නිරවශේෂයෙන් හැඳින ගත හැකිය. එසේ ම පරමාණුවේ ඉලෙක්ට්රෝන වින්යාසය මගින් නිර්ණය කරනු ලබන පරිද්දෙන් එහි (පරමාණුවේ) දක්නා ලක්ෂණ පිළිබඳ වඩා නිවැරදි අවබෝධයක් ද එමගින් ලබා ගත හැකිය.
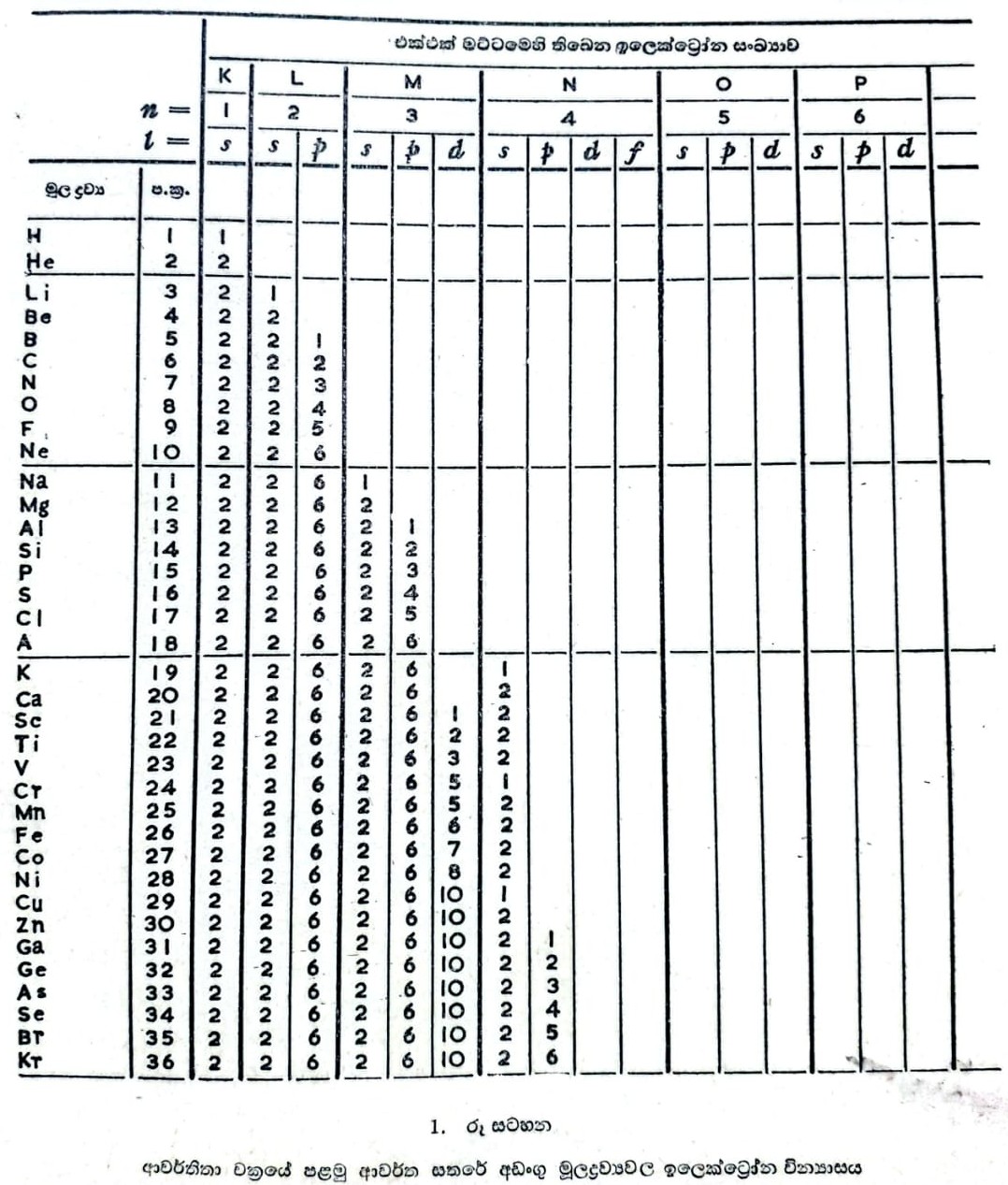
මේ ක්වොන්ටම් අංකවලින් එකක් ප්රධාන ක්වොන්ටම් අංකය (n) නමින් හැඳින්වේ. වඩා පැරණි සංකල්ප අනුව n සලකනු ලැබුණේ ඉලෙක්ට්රෝනය තිබෙන විශේෂ කක්ෂයේ හෙවත් කවචයේ ක්රමික සංඛ්යාව වශයෙනි. අනුයාත කවච 1, 2, 3, 4, 5, 6, 7 වශයෙන් අංකිත කොට ඇත. ඒවාට පිළිවෙළින් K, L, M, N, O, P, Q යන සංකේතයන් දී ඇත. මේ සංකේත ලබා ගෙන ඇත්තේ X-කිරණ වර්ණාවලී පිළිබඳ නාම කරණයෙනි. න්යෂ්ටිය හා සම්බන්ධයෙන් ශක්ති මට්ටමක පිහිටීම පමණක් මේ n සංකේතයෙන් දැක්වේ යයි දැන් සිතනු ලැබේ. ශක්ති මට්ටම් කිහිපයක ඉලෙක්ට්රෝන පිහිටා ඇතැයි සලකනු ලැබේ නම් ප්රධාන ක්වොන්ටම් අංකය වන nහි අගයන් අනුව මේ මට්ටම් එකිනෙකින් වෙන් කොට අඳුනාගත හැකිය. එබැවින් ප්රධාන ක්වොන්ටම් අංකය 2 ඇති ඉලෙක්ට්රෝන ක්වොන්ටම් අංකය 1 වූ ඉලෙක්ට්රෝනවලට වඩා ශක්ති සම්පන්නය (energetic). එහෙයින් ම මේවා සාමාන්යයෙන් ප්රධාන ක්වොන්ටම් අංකය 1 ඇති වූ ඉලෙක්ට්රෝනවලට වඩා න්යෂ්ටියට ඈතින් පිහිටා ඇත. කාර්ය්ය පහසුව තකා ශක්ති මට්ටම් ඉලෙක්ට්රෝන කවච වශයෙන් සලකා කවච පිළිබඳ පැරණි අංකනය භාවිතා කරනු ලැබේ. K කවචයට n=1 ද L කවචයට n=2 ද M කවචයට n=3 ද N කවචයට n=4 ද O කවචයට n=5 ද P කවචයට n=6 ද Q කවචයට n=7 ද යනුවෙන් භාවිත කෙරේ. ඕනෑ ම කවචයක, එනම් ඕනෑ ම ශක්ති මට්ටමක, තිබිය හැකි ඉලෙක්ට්රෝනවල උපරිම සංඛ්යාව කවච අංකය වර්ග කොට එය දෙකෙන් වැඩි කළ විට ලැබෙන සංඛ්යාවට සමානය (Ñ=2n2. මෙහි Ñ= කවචයේ තිබෙන උපරිම ඉලෙක්ට්රෝන සංඛ්යාව; n= කවච අංකය). එබැවින් අංක 1 දරන K කවචයේ තිබිය හැකි ඉලෙක්ට්රෝන සංඛ්යාව 2ක් වේ. අංක 2 දරන L කවචයේ තිබිය හැකි උපරිම ඉලෙක්ට්රෝන සංඛ්යාව 8ක් වේ. M කවචයේ තිබිය හැකි උපරිම ඉලෙක්ට්රෝන සංඛ්යාව 18ක් වේ. එක් එක් කවචයේ තිබිය හැකි ඉලෙක්ට්රෝන සංඛ්යාව මෙලෙස නිර්ණය කළ හැකිය. පැලේඩියම් හැර ඕනෑ ම මූලද්රව්යයක පරමාණුවක පිටතින් ම ඇති ස්තරයේ තිබෙන ඉලෙක්ට්රෝන සංඛ්යාව 8ට වඩා වැඩි නොවිය හැකි බව ද අන්තිම ස්තරයට ඇතුළෙන් ඇති ස්තරයේ ඉලෙක්ට්රෝන සංඛ්යාව 18කට වඩා වැඩි නොවිය හැකි බව ද දැනගෙන තිබේ.
දෙවැනි ක්වොන්ටම් අංකය l නමින් හැඳින්වේ. මෙයට උද්දිගංශ (azimuthal) ක්වොන්ටම් අංකය යයි ද කියනු ලැබේ. න්යෂ්ටිය වටා සිදු වන කක්ෂීය චලනයේ හේතුවෙන් ඉලෙක්ට්රෝනයක ඇති වන ශක්ති කොටස මේ අංකයෙන් විස්තර කරනු ලැබේ. ඉලෙක්ට්රෝන ආශ්රයේ හැඩය (කක්ෂයේ හැඩය) ද එහි සාන්තත්යය හෝ අසාන්තත්යය ද එහි දිග්ගැස්සීම ද දෙවැනි ක්වොන්ටම් අංකයෙන් විස්තර කෙරේ. lහි විශාලත්වය වූකලි h/2π ඒකකවලින් මනිනු ලබන ඉලෙක්ට්රෝනයක කක්ෂීය කෝණික ගම්යතාවේ (orbital angular momentum) මිනුමකි. මෙහි h යනුවෙන් හැඳින්වෙන්නේ ප්ලාංක් නියතය (Planck's constant) වේ. lහි සංඛ්යාත්මක අගයන් අනුව ඉලෙක්ට්රෝන විස්තර කළ හැකි වුවත් ඒ සඳහා තුල්යාත්මක අක්ෂර නාම යොදනු ලැබේ. මෙසේ l=0 ඉලෙක්ට්රෝන s ඉලෙක්ට්රෝන වශයෙන් ද l=1 ඉලෙක්ට්රෝන p ඉලෙක්ට්රෝන වශයෙන් ද l=2 ඉලෙක්ට්රෝන d ඉලෙක්ට්රෝන වශයෙන් ද l=3 ඉලෙක්ට්රෝන f ඉලෙක්ට්රෝන වශයෙන් ද නම් කරනු ලැබේ. s, p, d, f යන තුල්යාත්මක අක්ෂරයන් ලබාගෙන ඇත්තේ පළමුවෙන් වර්ණාවලිවලට භාවිත වුණු ෂාප් (sharp), ප්රින්සිපල් (principal), ඩිෆ්යුස් (diffuse) හා ෆන්ඩමෙන්ටල් (fundamental) යන පැරණි පදවලිනි. එක් එක් ප්රධාන ක්වොන්ටම් අංකය n හා අනුබද්ධව දෙවැනි (උද්දිගංශ) ක්වොන්ටම් අංකය lවලට 0 (ශුන්යයේ) සිට n-l දක්වා පූර්ණ සංඛ්යාවල අගයන් ලැබිය හැකිය. n-l නම් l වලට ඇති විය හැක්කේ 0 හෙවත් s අගය පමණි. මෙහි දී ඉලෙක්ට්රෝන ආශ්රය ගෝලයක හැඩයෙන් යුක්ත වන අතර එම ආශ්රයේ තිබිය හැකි උපරිම ඉලෙක්ට්රෝන ගණන 2 කි. n=2 නම් l වලට 0 හෙවත් s හා l හෙවත් p අගයන් ඇති විය හැකිය. මෙහි දී ඉලෙක්ට්රෝන ආශ්රයෙහි sහි 2ක් ද, pහි 6ක් ද වශයෙන් උපරිම ඉලෙක්ට්රෝන සංඛ්යාවක් තිබිය හැකිය. n=3 නම් l වලට 0 හෙවත් s ද l හෙවත් p ද 2 හෙවත් d ද යන අගයන් ඇති විය හැකිය. මෙහි දී sහි දෙකක් ද, pහි 6ක්ද, dහි 10ක් ද වශයෙන් උපරිම ඉලෙක්ට්රෝන සංඛ්යාවක් ඉලෙක්ට්රෝන ආශ්රයෙහි තිබිය හැකිය. අනික් ඒවා ද මේ නයින් දත යුතුයි.
තුන්වැනි ක්වොන්ටම් අංකය චුම්බක (magnetic) ක්වොන්ටම් අංකය වේ. එය ml යනුවෙන් හැඳින්වේ. මේ අංකය වූකලි චුම්බක ක්ෂේත්රයක බැමවෙන පරමාණුවක හෝ අණුවක ක්වොන්ටීකෘත කෝණික ගම්යතාව h/2π හි ගුණිතයක් සේ ප්රකාශ කරන පූර්ණ සංඛ්යාවකි. (ක්වෝන්ටම් යාන්ත්ර විද්යාව බ.)
පරමාණුවක තිබෙන ඉලෙක්ට්රෝන න්යෂ්ටිය වටා භ්රමණය වනු පමණක් නොව ඒවා ස්වකීය අක්ෂය වටාත් භ්රමණය වේ. එබැවින් එහි භ්රමණය ප්රතිවිරුද්ධ දිසාවන් දෙකක සිදු වන්නට පුළුවන. ඉලෙක්ට්රෝනයේ මේ භ්රමණය වීම සතරවැනි ක්වොන්ටම් අංකයෙන් විස්තර කෙරේ. මේ සතර වැනි ක්වොන්ටම් අංකයට බැමුම් (spin) ක්වොන්ටම් අංකය යයි කියනු ලැබේ. එය ms යනුවෙන් හැඳින්වේ. බැමුම් ක්වොන්ටම් අංකයේ අගය + 1/2 හෝ − 1/2 හෝ වේ. එබැවින් n, l හා ml යන අනික් ක්වොන්ටම් අංක තුනේ ඇති විය හැකි එක් එක් සංයෝජනයට (combination) බැමුමෙන් පමණක් එකිනෙකට වෙනස් වන ඉලෙක්ට්රෝන දෙකක් තිබිය හැකිය. පව්ලිගේ බහිෂ්කාර නියමය (Pauli's exclusion principle) අනුව එක ම පරමාණුවක තිබෙන කිසි ම ඉලෙක්ට්රෝන දෙකකට ක්වොන්ටම් අංක සතර ම සර්වසමව තිබිය නොහැකිය. එහෙයින් n, l හා ml එක ම වන ඉලෙක්ට්රෝන යුගලයක් ඇත්නම් ඒවා එකිනෙකට විරුද්ධ අතට භ්රමණය වේ.
පරමාණුවල ඉගෙක්ට්රෝන පිළියෙල වී තිබෙන ආකාරය කෙටි සූත්රවලින් දැක්විය හැකිය. මෙහි දී ප්රධාන ක්වොන්ටම් අංකය දක්වන ඉලක්කම පළමුවෙන් ලියනු ලැබේ. උද්දිගංශ ක්වොන්ටම් අංකය දක්වන අකුර මීට පසුව ලියනු ලැබේ. අනුරූප වන එක් එක් කක්ෂයේ ඉලෙක්ට්රෝන සංඛ්යාව මේ අකුරට උඩින් ලියනු ලැබේ. මෙලෙස හයිඩ්රජන් පරමාණුවේ ඉලෙක්ට්රෝන සූත්රය 1s1 වේ. හීලියම් පරමාණුවේ ඉලෙක්ට්රෝන සූත්රය 1s2 වේ. 1s2 2s1 ලීතියම්වල ද 1s2 2s2 2p4 ඔක්සිජන්වල ද 1s2 2s2 2p6 3s1 සෝඩියම්වල 1s2 2s2 2p6 3s2 3p4 සල්පර්වල ද 1s2 2s2 2p6 3s2 3p6 3d6 4s2 යකඩවල ද ඉලෙක්ට්රෝන සූත්ර වේ.
මූලද්රව්යයන්ගේ පරමාණුවල ඉලෙක්ට්රෝන වින්යාසය පෙන්නුම් කරන චක්රයක මුල් කොටස 1 රූ සටහනේ දැක්වේ.
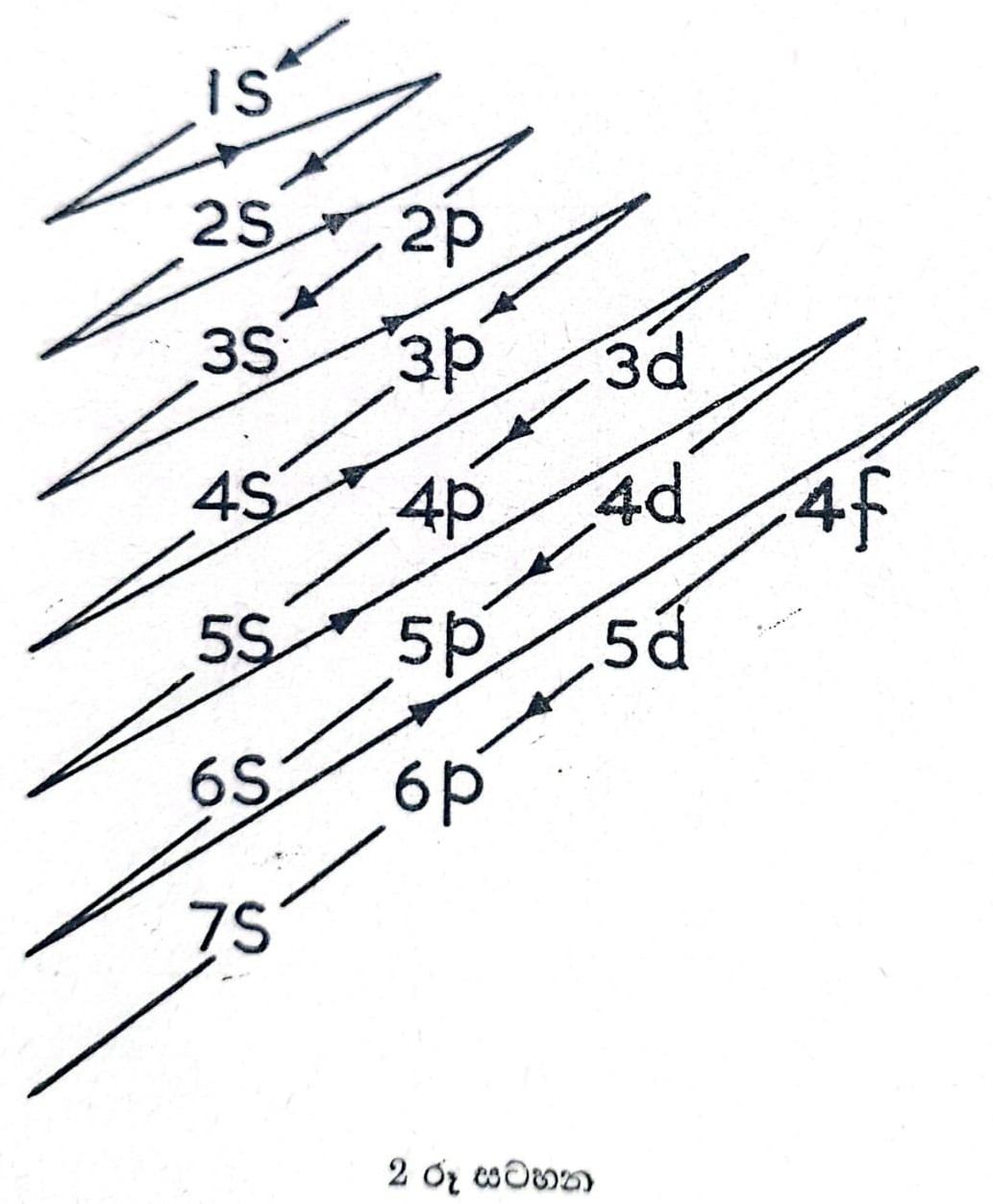
පරමාණුවල ඉලෙක්ට්රෝන ස්තර වර්ධනය වන ආකාරය ද පරමාණුක ක්රමාංකය වැඩි වත් ම ඒවා ක්රමයෙන් ඉලෙක්ට්රෝනවලින් පිරෙන ආකාරය ද රිද්මයකට අනුව කක්ෂයන්හි 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2 යනාදි වශයෙන් ඉලෙක්ට්රෝන පිරීම ද 2 රූ සටහනේ දැක්වෙන චක්රයෙන් බලාගත හැකිය. පරමාණුවක තිබෙන ඉලෙක්ට්රෝනයන්ගේ මුළුමහත් සංකීර්ණ චලන සමස්තය ම මේ ක්වොන්ටම් අංක සතරෙන් විදහා දැක්විය හැකිය. එහෙත් පරමාණුවක ඉලෙක්ට්රෝන පිළියෙල වී තිබෙන ආකාරය පිළිබඳ සර්වසම්පූර්ණ සංකල්පයක් මේවායින් නොලැබේ. මීට හේතුව නම් ඉලෙක්ට්රෝන එකිනෙක සමග ආකස්මිකව ඇති කරගන්නා සංයෝජනයන්ගේ සංඛ්යාව සීමාසහිත වීමය.
පරමාණුවේ ව්යූහය පිළිබඳ අධ්යයනයේ දී අලුතෙන් සොයාගත් කරුණු හේතු කොටගෙන ආවර්තිතා නියමය හා ආවර්තිතා චක්රය පිළිබඳව වඩා ගැඹුරු අවබෝධයක් ලබාගැනීමට පුළුවන් විය. මූලද්රව්යයන්ගේ ආවර්තිතා පද්ධතියකින් පිළිබිඹු වන්නේ හිතුමතයට තෝරාගත් කිසියම් පදනමක ශ්රිතයක් වශයෙන් මේ මූලද්රව්යයන්ගේ ගුණවල ආවර්ත වෙනස්වීම්ය. මෙන්ඩලේයෆ් (බ.) ස්වකීය ආවර්තිතා චක්රය ක්රමවත්ව සකස් කිරීමේ දී මේ පදනම වශයෙන් තෝරාගත්තේ පරමාණුක භාරයයි. එය මූලද්රව්යයන් පිළිබඳව එකල දත් එක් ගුණයක් වූ හෙයිනි. පරමාණුක භාරය න්යෂ්ටික ගුණයක් වන බැවින් මූලද්රව්යයක රසායනික ගුණ කෙරෙහි එයින් වැඩි බලපෑමක් ඇති නොවේ. රසායනික හා භෞතික ගුණ සාමාන්යයෙන් පාලනය කරනු ලබන්නේ ඉලෙක්ට්රෝන මගිනි. පරමාණුවක් විද්යුත් වශයෙන් සලකන කල උදාසීන හෙයින් එහි ඇති ඉලෙක්ට්රෝන සංඛ්යාව න්යෂ්ටියේ ඇති ප්රෝටෝන සංඛ්යාවට ද සමාන වේ. එබැවින් පරමාණුක ක්රමාංකය ඒ ඒ මූලද්රව්යයන්ගේ භෞතික හා රසායනික ගුණ පාලනය කරයි.
මෙන්ඩලේයෆ්ගේ ආවර්තිතා චක්රයෙහි පරස්පර විරෝධයක් සේ පෙනුණු කරුණක් නම් වැඩි පරමාණුක භාරයක් ඇති ඇතැම් මූලද්රව්යයන් ඊට වඩා අඩු පරමාණුක භාරයන් ඇති මූලද්රව්යයන්ට පෙරාතුව තැබීමයි (නි. ආගන් හා පොටෑසියම්; ටෙලුරියම් හා අයඩීන්; කොබොල්ට් හා නිකල්). එක් එක් මූලද්රව්යයක පිහිටීම එහි පරමාණුක ක්රමාංකය අනුව නිර්ණය කළ විට මේ පරස්පරය මගහැරේ. ආවර්තිතා නියමය දැන් සූත්රගත කොට ඇත්තේ මූල ද්රව්යයන්ගේ ගුණ ඒවායේ පරමාණුවල ඇති න්යෂ්ටික ආරෝපණවල, එනම් පරමාණුක ක්රමාංකයෙහි ආවර්තිතා ශ්රිතයකැයි යනුවෙනි. පරමාණුක ව්යූහය පිළිබඳව ලත් දැනුම ආවර්තිතා නියමයේ භෞතික අර්ථය එළිදරවු කිරීමට ද හේතු විය. මෙන්ඩලේයෆ්ගේ කාලයේ දී මෙය අස්ඵුටව පැවතිණ. පරමාණුක න්යෂ්ටිවල ආරෝපණ වැඩි වත් ම පරමාණුවල පිටස්තර ස්තරයන්හි තිබෙන ඉලෙක්ට්රෝනවල ඒකාකාර වූ සංයෝජන නිරන්තරයෙන් නැවත නැවතත් ඇති වන බව පරමාණුවල ඉලෙක්ට්රෝන වින්යාසය දක්වන චක්රය දෙස බැලූ විට අපට ප්රත්යක්ෂ වේ. මෙපරිදි, රසායනික මූලද්රව්යයන්ගේ ගුණ අතින් දක්නා ආවර්ත ක්රමාන්වයට හේතු වන්නේ මූල ද්රව්ය එම ඉලෙක්ට්රෝන කාණ්ඩවලටම ආවර්තිතා ලෙස නැවත නැවතත් පැමිණීම බව පෙනේ. මූලද්රව්යයන් සියල්ලේ ම පරමාණුවල ඇති න්යෂ්ටික ආරෝපණය X-කිරණ වර්ණාවලි මගින් නිර්ණය කොට ඇත. මූලද්රව්යයන්ගේ පරමාණු න්යෂ්ටිවල ඇති ආරෝපණ පිළිවෙළින් වැඩි වන ආකාරයට ආවර්තිතා චක්රයෙහි මූලද්රව්ය අනම්ය අනුක්රමයකට යොදා තිබේ. එක් එක් වාරයේ දී න්යෂ්ටියට එක ධන ආරෝපණයක් එකතු කිරීමෙන් ද එය හේතුකොටගෙන එකතු කළ යුතු වැඩි ඉලෙක්ට්රෝනය පද්ධතියේ සුදුසු ස්ථානයෙහි තැබීමෙන් ද ආවර්තිතා චක්රයෙහි එක් මූලද්රව්යයක සිට ඊළඟ මූලද්රව්යය කරා අපට යා හැකිය.
පරමාණුවක ඉලෙක්ට්රෝන කවචවල ව්යූහය තහවුරු කරගත් පසු එය ආවර්තිතා චක්රයේ මුළු නිර්මාණය කෙරෙහි ම බලපෑවේය. කලින් මූලද්රව්යයන් ආවර්තවලට බෙදා තිබුණු ක්රමයෙහි වෙනස් වීම් කිහිපයක් ඇති කිරීමට හේතු වූයේ මෙයයි. තනි සංයුජතා (single valency) ඉලෙක්ට්රෝනයක් වශයෙන් අලුත් ඉලෙක්ට්රෝන ස්තරයක් පළමුවෙන් ඇති වන මූලද්රව්යයකින් එක් එක් අලුත් ආවර්තය ආරම්භ විය යුතු බව මෙකල දැනගෙන ඇත (නි. හයිඩ්රජන් හා ක්ෂාරීය ලෝහ). මේ ආවර්තය අවසාන විය යුත්තේ ඒ ස්තරයේ ඉලෙක්ට්රෝන 8කින් යුත් මූලද්රව්යයකිනි. නිෂ්ක්රිය වායුවලට ලාක්ෂණික වූ අතිශයින් ස්ථායී ඉලෙක්ට්රෝන අෂ්ටකය (octet) මෙසේ සෑදේ. මෙසේ මූලද්රව්යයන් ස්වාභාවික ලෙස ආවර්තවලට බෙදීමෙන් අලුත් ආවර්තිතා චක්රයක් පිළියෙල වීමට මග පෙන්විණි. මේ අලුත් චක්රයේ ශූන්ය කාණ්ඩය (zero group) ඇත්තේ චක්රයේ දකුණු පැත්තේ VII වැනි කාණ්ඩයට පසුවය. ආවර්තිතා චක්රයේ විරල පාංශු මූලද්රව්යයන් (අංක 58-71) තිබිය යුතු ස්ථානය පිළිබඳ ප්රශ්නයත්, අන්තරික මූලද්රව්යයන්හි ගුණත්, ආවර්තිතා චක්රයේ කාණ්ඩ හා ආවර්ත දිගේ ඇති වන රිද්මානුකූල ගුණ වෙනස්වීමත් පරමාණුක ව්යූහය පිළිබඳ දැනීම නිසා පැහැදිලි විය. (ඉලෙක්ට්රෝනය; ආවර්තිතා චක්රය යන ලිපි ද බලන්න.)
(සංස්කරණය: 1970)